第一作者:甘国强 博士;通讯作者:李新勇 教授;
通讯单位:大连理工大学
论文DOI:10.1016/j.nanoen.2020.105532

全文速览
大连理工大学李新勇教授课题组长期专注于Cl-VOCs的催化转换研究。近日,该课题组在1,2-二氯乙烷电催化脱氯方面的研究中取得新进展,相关成果发表于国际顶级期刊Nano Energy上。为了降低1,2-二氯乙烷电催化还原脱氯体系中的氯离子浓度,作者设计了耦合反应体系,在阳极引入苯甲醚的氯化反应,将阴极产生的氯离子在阳极重复利用,并且同时以单原子Fe-N-C催化剂为阴极和阳极。作者发现,阳极苯甲醚氯化反应的引入显著降低了体系中氯离子浓度,使得阴极反应速率显著提升。并且经过实验和理论计算分析发现,Fe-N4为阴极和阳极反应的双功能位点。本研究为Cl-VOCs类污染物的控制以及芳基化合物的氯化提供了高效经济的途径。

背景介绍
Cl-VOCs的催化转化一直是环境领域的一个研究重点。1,2-二氯乙烷作为一种常用的典型Cl-VOCs,在实际生产中排放来源广泛,具有较高的研究价值。该课题组之前的研究(ACS Catalysis, 2019, 9, 10931−10939,ACS Nano, 2020, 14, 9929−9937)发现,电催化还原能高效的去除1,2-二氯乙烷的氯原子,降低其毒性,具有显著的环境意义,同时还能够回收高附加值的产物乙烯,具有较高的经济价值。然而,反应过程中,体系中氯离子的大量累积,有可能会对反应带来影响。并且阳极无有效反应的发生,也限制了反应的经济价值。因此,对体系中的氯离子加以资源化利用,并且在阳极引入有价值的反应具有较高的意义。
氯代芳香基化合物中氯官能团往往扮演着重要的作用,特别是在制药领域。但是氯代芳香基化合物的制备一直都是个难点。在1,2-二氯乙烷电催化还原脱氯体系中,氯离子在阳极会被氧化成Cl2。研究者在1,2-二氯乙烷电催化还原脱氯体系的阳极引入芳基化物,使得体系中的Cl-在阳极作为氯化试剂,制备氯代芳基化合物,而不是产生Cl2。该方法无需其他任何氧化剂,环境友好。而这种耦合策略不仅显著提升了阴极1,2-二氯乙烷电催化脱氯产乙烯的反应速率,同时也为芳基化合物的制备提供了一条高效经济的路径。
本文亮点
构建了耦合反应体系,同时以单原子Fe-N-C催化剂为阴极和阳极,将阴极1,2-二氯乙烷电催化还原产生的Cl-在阳极重复利用,作为氯化试剂制备氯代芳基化合物;并且经过实验和理论计算分析发现,Fe-N4为阴极和阳极反应的双功能位点。
图文解析
利用铁模板诱导多巴胺聚合反应制备了超薄Fe–Nx–Cns单原子催化剂。如图1所示,FeCl3·6H2O诱导多巴胺横向聚合。反应中FeCl3·6H2O有三重作用:模板、氧化剂、铁源。为了降低表面张力,形成超薄的层状结构,采用冷冻干燥工艺。在此基础上,800 ℃煅烧,浸渍和洗涤后得到最终产物。由SEM、TEM以及AFM综合证明所得材料为超薄的纳米片构型。
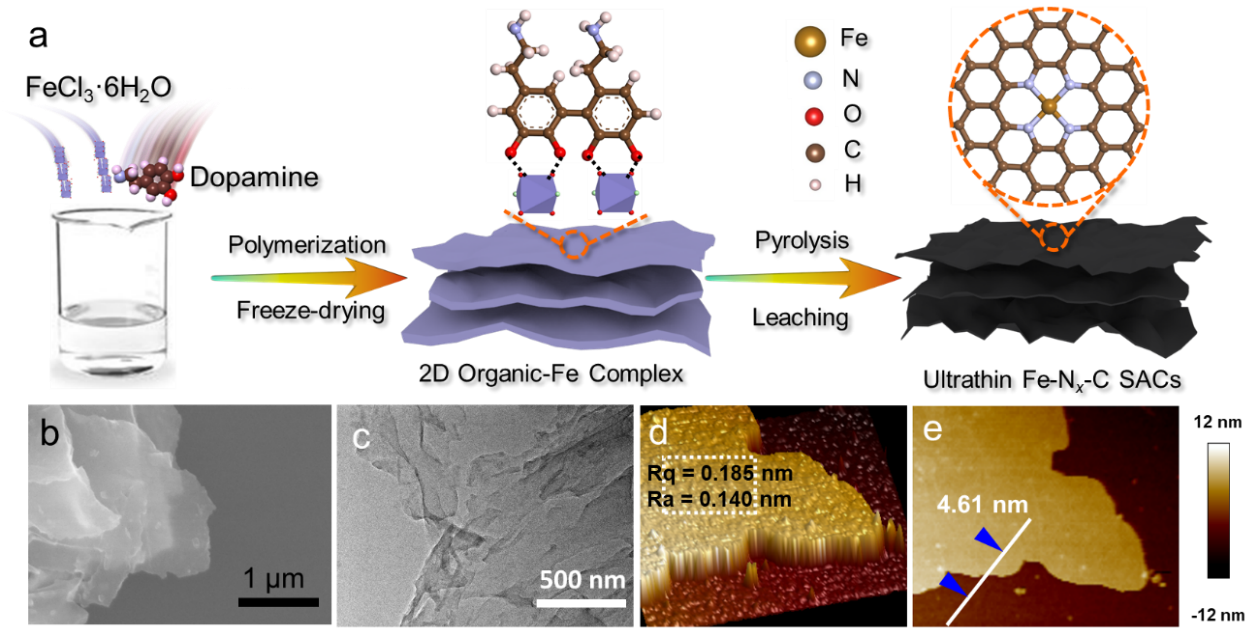
Fig. 1. (a) Schematic synthesis process, (b) SEM image, (c) TEM image, (d) 3D AFM image with surface roughness (Rq and Ra), and (e) 2D AFM image with thickness profile of ultrathin Fe−Nx−C SACs.
采用XRD、Raman、ICP-OES、SAED、STEM、XPS以及XAS综合证明了单原子的Fe以及其精细的配位结构,如图2所示。Fe以单原子的形式均匀的分散在C基骨架上,其主要配位形式为Fe-N4O2,即在Fe除了在横向上与4个N配位以外,纵向上分别以收尾相连的形式与两个O原子配位。但是,由于Fe-O键在电化学还原的过程中很容易被还原。因此,在电催化还原脱氯反应过程中主要是Fe-N4结构。
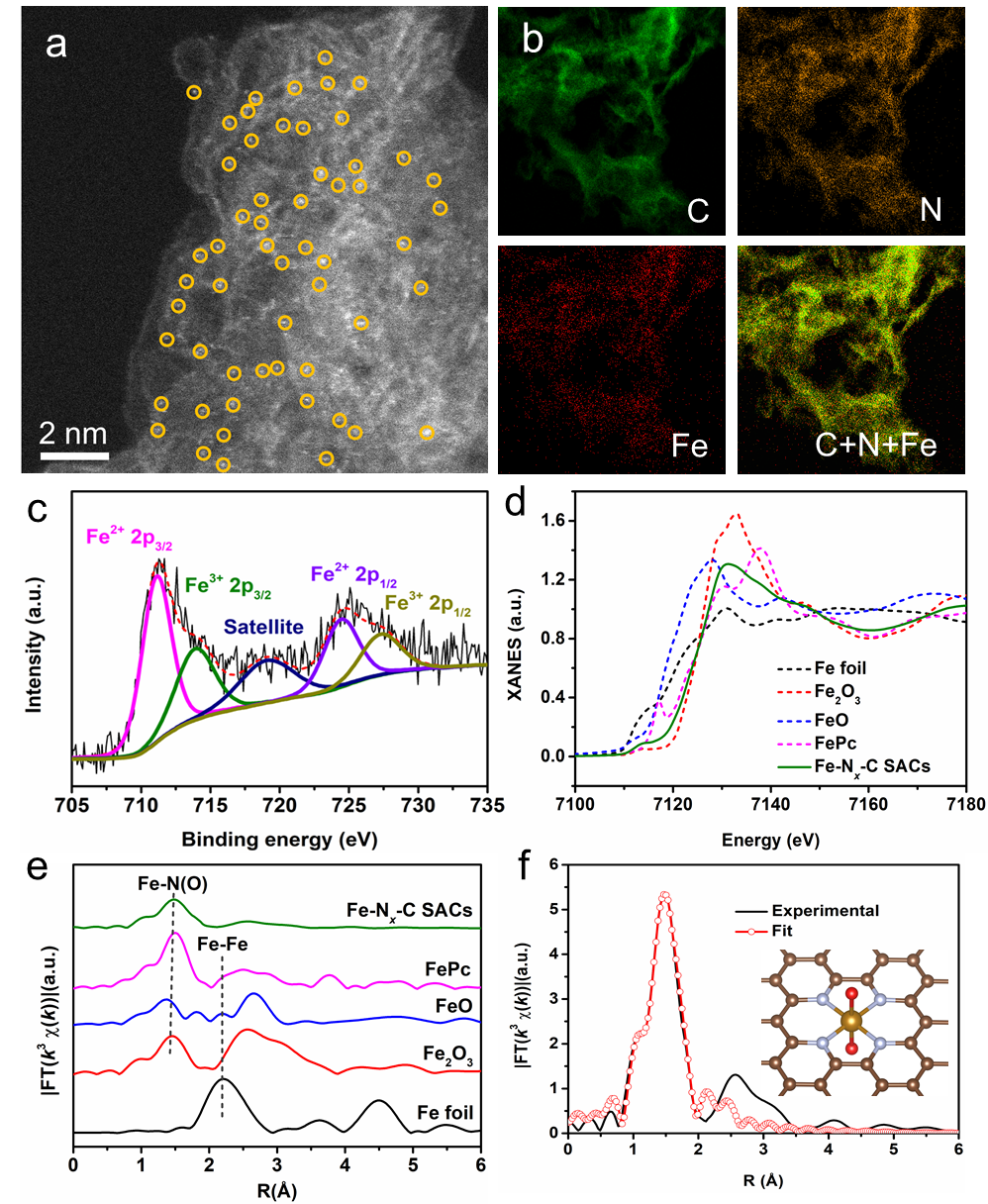
Fig. 2. (a) HAADF-STEM image, (b) related elemental mappings, (c) Fe 2p XPS spectra of ultrathin Fe−Nx−C SACs. (d) XANES spectra at the Fe K-edge, and (e) FT k3-weighted χ(k)-function of the EXAFS spectra in R space of the Fe foil, Fe2O3, FeO, FePc and Fe−Nx−C SACs. (f) A comparison between the experimental FT-EXAFS spectrum in R space and the fitting spectrum that is simulated based on the predicted structure of the FeN4C10 moiety with two O2 molecules adsorbed in end-on mode.
电化学性能分析中,作者首先详细的考察了阳极芳基化合物氯化半反应。由循环伏安曲线以及理论计算发现,在反应条件下,苯甲醚的氯化电位远小于Cl-氧化电位,说明Cl-更易于苯甲醚发生反应。在此基础上,作者详细分析了材料种类以及电位对反应产率、选择性以及法拉第电流效率的影响,并且分析了反应的稳定性。
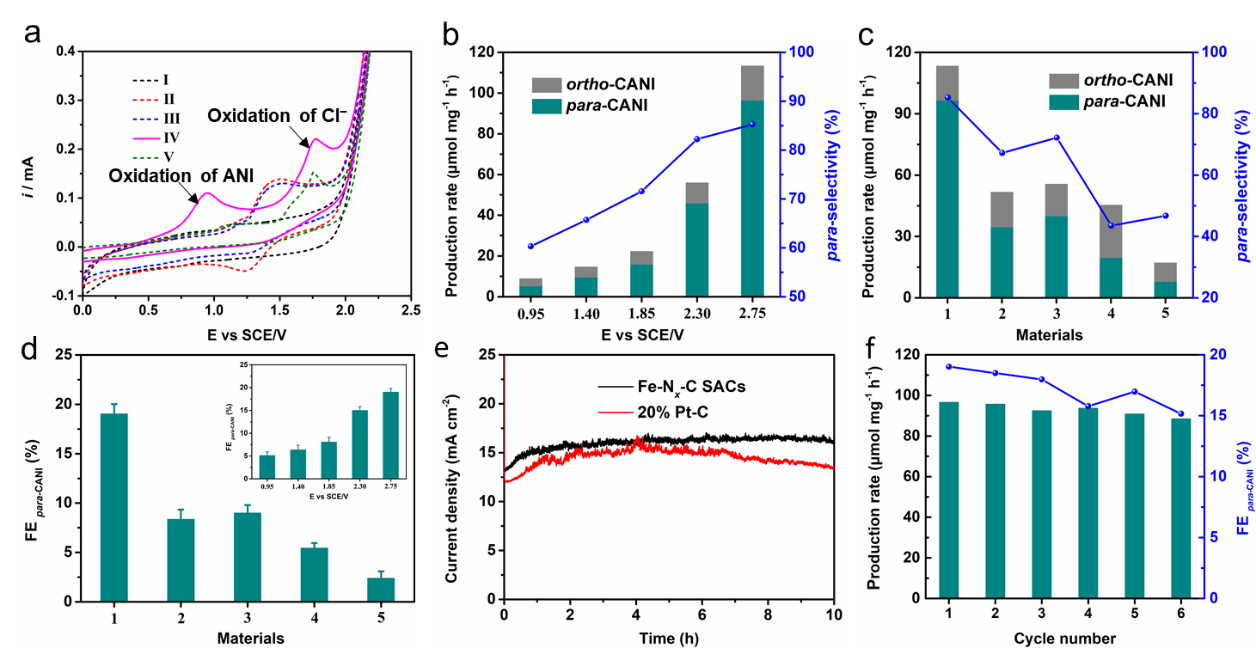
Fig. 3. (a) Cyclic voltammetry curves recorded on the Fe−Nx−C SACs electrode in (Ⅰ) 0.1 M n-Bu4NBF4 in DMF; (Ⅱ) 0.01 M Me4NCl, and 0.1 M n-Bu4NBF4 in DMF; (Ⅲ) 0.01 M ANI, 0.01 M Me4NCl, and 0.1 M n-Bu4NBF4 in DMF; (Ⅳ) 0.01 M Bu4NOH, 0.01 M ANI, 0.01 M Me4NCl, and 0.1 M n-Bu4NBF4 in DMF; (Ⅴ) 0.01 M Bu4NOH, 0.01 M Me4NCl, and 0.1 M n-Bu4NBF4 in DMF. (b) Production rate and para−CANI selectivity of the Fe−Nx−C SACs under different potentials. (c) Production rate and para−CANI selectivity of (1) Fe−Nx−C SACs; (2) Fe−C catalysts; (3) 20% Pt−C; (4) Graphite electrode; and (5) Pt-plate electrode. (d) FE para−CANI of different catalysts, the insert picture is the FE para−CANI under different potentials. (e) Current density of the Fe−Nx−C SACs and 20% Pt−C during 10 h ACR. f) para−CANI production rate and FE for six successive electrolysis cycles.
如图4所示,作者利用DFT理论计算分别分析了石墨、Fe-N4、铁纳米颗粒、铂片在阳极苯甲醚氯化反应中的反应能垒和控速步骤的差分电荷分布图。结果发现Fe-N4位点的反应能垒最低,为0.93 eV,说明Fe-N4为苯甲醚氯化产对氯代苯甲醚的主要活性位点。同时,产对氯代苯甲醚的能垒小于产邻氯代苯甲醚的能垒,进一步说明了对氯代苯甲醚的选择性高。由差分电荷分布发现,石墨、铁纳米颗粒以及铂片在反应中,中间产物与材料之间形成多个键,电子转移较高,不利于产物的脱附,而Fe-N4位点与中间产物仅成一个化学键,并且电子转移较低,进一步说明Fe-N4位点优异的反应活性。
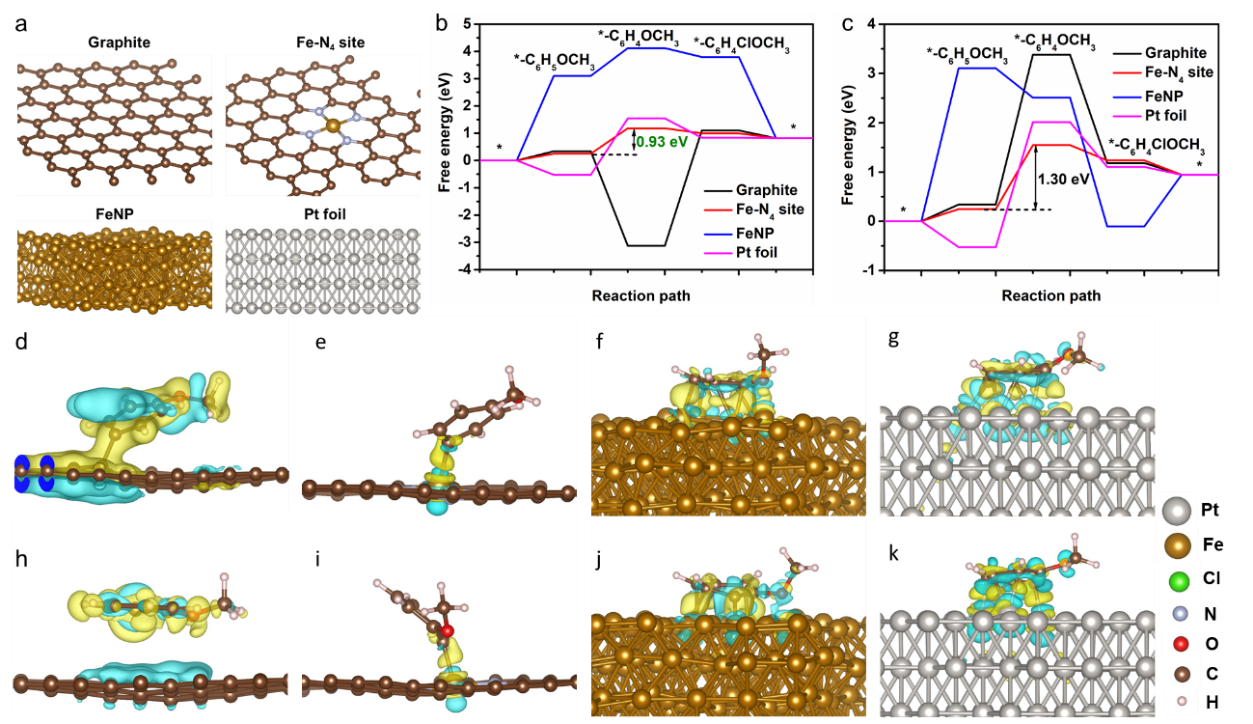
Fig. 4. (a) Geometry structure of graphite, Fe−N4 site, FeNP, and Pt foil at the atomic level from the first−principle. (b, c) Calculated energy profiles for ACR into (b) para−CANI and (c) ortho−CANI on graphite, Fe−N4 site, FeNP, and Pt foil. (d-k) The charge density difference mappings for rate-determining step on (d, h) graphite, (e, i) Fe−N4 site, (f, j) FeNP, and g, k) Pt foil, d-g for para−CANI, and h-k for ortho−CANI.
在此基础上,系统考察的双极耦合反应,如图5所示。结果发现,阳极反应的引入,显著加快了阴极脱氯反应的速率,同时,体系中氯离子的浓度也显著降低,并且这种耦合体系也呈现出较好的稳定性和重复性。在此基础上,推测了可能的双极耦合反应的反应路径。

Fig. 5. (a) Schematic illustration for EER ‖ ACR. (b) LSV curves, and (c) Tafel plots for the EER with and without 0.10 M ANI. (d) Production rate and FE for six successive electrolysis cycles. (e) Stability test of the EER ‖ ACR, insert pictures are the diagram of actual reaction and production rate of para−CANI during 12 h, respectively. (f) Concentration of Cl− in the electrolyte solution with and without 0.10 M ANI.